Suchfunktion
Filter
Berufliche Schulen
Bildungsplanarbeit für die Beruflichen Gymnasien 2021
Chemie
Klasse 9, 10
Allgemeine Vorbemerkungen
Der Bildungsplan zeichnet sich durch Inhalts- und Kompetenzorientierung aus. In jeder Bildungsplaneinheit (BPE) werden in kursiver Schrift die übergeordneten Ziele beschrieben, die durch Zielformulierungen sowie Inhalts- und Hinweisspalte konkretisiert werden. In den Zielformulierungen werden die jeweiligen fachspezifischen Operatoren als Verben verwendet. Operatoren sind handlungsinitiierende Verben, die signalisieren, welche Tätigkeiten beim Bearbeiten von Aufgaben erwartet werden. Die für das jeweilige Fach relevanten Operatoren sowie deren fachspezifische Bedeutung sind jedem Bildungsplan im Anhang beigefügt. Durch die kompetenzorientierte Zielformulierung mittels dieser Operatoren wird das Anforderungsniveau bezüglich der Inhalte und der zu erwerbenden Kompetenzen definiert. Die formulierten Ziele und Inhalte sind verbindlich und damit prüfungsrelevant. Sie stellen die Regelanforderungen im jeweiligen Fach dar. Die Inhalte der Hinweisspalte sind unverbindliche Ergänzungen zur Inhaltsspalte und umfassen Beispiele, didaktische Hinweise und Querverweise auf andere Fächer bzw. BPE.
Der VIP-Bereich im Bildungsplan umfasst Vertiefung, individualisiertes Lernen sowie Projektunterricht. Im Rahmen der hier zur Verfügung stehenden Stunden sollen die Schülerinnen und Schüler bestmöglich unterstützt und bei der Weiterentwicklung ihrer personalen und fachlichen Kompetenzen gefördert werden. Die Fachlehrerinnen und Fachlehrer nutzen diese Unterrichtszeit nach eigenen Schwerpunktsetzungen auf Basis der fächerspezifischen Besonderheiten und nach den Lernvoraussetzungen der einzelnen Schülerinnen und Schüler.
Der Teil „Zeit für Leistungsfeststellung“ des Bildungsplans berücksichtigt die Zeit, die zur Vorbereitung, Durchführung und Nachbereitung von Leistungsfeststellungen zur Verfügung steht. Dies kann auch die notwendige Zeit für die gleichwertige Feststellung von Schülerleistungen (GFS), Nachbesprechung zu Leistungsfeststellungen sowie Feedback-Gespräche umfassen.
Fachbezogene Vorbemerkungen
„Dass ich erkenne, was die Welt im Innersten zusammenhält“ (Goethe, Faust I). Die Beantwortung dieser Frage ist sowohl für den einzelnen Menschen als auch für die Gesellschaft außerordentlich wichtig. Als Naturwissenschaft liefert die Chemie dazu einen wesentlichen Beitrag. Ziel eines zeitgemäßen Chemieunterrichtes ist deshalb, jeden Einzelnen zu befähigen, seiner Verantwortung in allen Bereichen der Technik, Wirtschaft, Ökologie und Kultur bewusst nachzukommen.
Fachliche Aussagen zum Kompetenzerwerb in der Mittelstufe
Naturwissenschaftliche Kompetenz zeigt sich darin, die charakteristischen Eigenschaften unserer Umwelt sowie die Bedeutung der Naturwissenschaften in unserer heutigen Welt zu verstehen. Sie befähigt die Lernenden, naturwissenschaftliches Wissen anzuwenden, um Fragestellungen zu erkennen, naturwissenschaftliche Phänomene zu beschreiben und aus Belegen Schlussfolgerungen zu ziehen. Diese Kompetenz schließt auch die Bereitschaft mit ein, sich reflektierend mit naturwissenschaftlichen Ideen und Themen auseinanderzusetzen und ermöglicht es den Schülerinnen und Schülern darüber hinaus Problemstellungen zu bewältigen, die wir heute noch nicht kennen.
Der Bildungsplan für den Chemieunterricht zielt deshalb auf das Verständnis und die Anwendung grundlegender chemischer Begriffe, Gesetzmäßigkeiten, Konzepte und Modelle ab. Gelungene naturwissenschaftliche Bildung zeigt sich in der Fähigkeit, chemische Fragestellungen zu erkennen, chemisches Wissen anzuwenden, aus chemischen Fakten Schlussfolgerungen zu ziehen und Bewertungen aufgrund einer naturwissenschaftlich-rationalen Abwägung vorzunehmen. Dazu sind sowohl inhaltsbezogene als auch prozessbezogene Kompetenzen nötig.
Der Bildungsplan legt das Anforderungsniveau gemäß der Bildungsstandards für den Mittleren Schulabschluss der Kultusministerkonferenz in diesem Fach zu Grunde. Die Bildungsstandards definieren bezüglich der chemischen Fachkompetenz vier Fachkompetenzbereiche, die – wie auch in den anderen Naturwissenschaften – eine Inhaltsdimension und eine Handlungsdimension umfassen. Die Inhaltsdimension wird überwiegend im Kompetenzbereich Fachwissen, die Handlungsdimension in den Kompetenzbereichen Erkenntnisgewinnung, Kommunikation und Bewertung dargestellt. Inhalts- und handlungsbezogene Kompetenzen greifen ineinander und werden in der Regel gemeinsam erworben. Durch das Zusammenwirken der vier Fachkompetenzbereiche entwickelt sich die chemische Fachkompetenz.
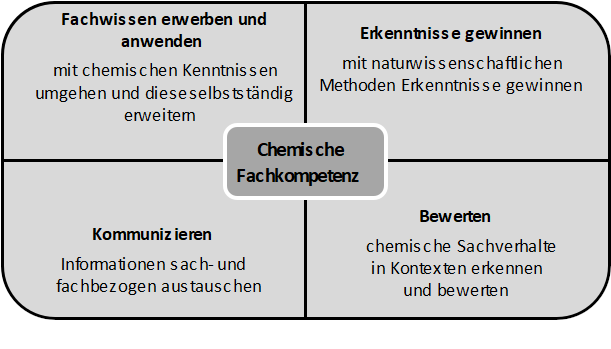 |
- Fachwissen: Die chemischen Fachinhalte (wie z. B. chemische Phänomene, grundlegende Begriffe und Gesetzmäßigkeiten, Prinzipien der Chemie) können in der Sekundarstufe I auf vier Basiskonzepte (Stoff-Teilchen-Beziehungen, Struktur-Eigenschafts-Beziehungen, chemische Reaktion und energetische Betrachtung bei Stoffumwandlungen) zurückgeführt und mit deren Hilfe strukturiert und sowohl horizontal wie vertikal vernetzt werden.
- Erkenntnisgewinnung: Die Denk- und Arbeitsweise in der Chemie findet in diesem Fachkompetenzbereich ihren Niederschlag: Durch Experimente oder mithilfe geeigneter Modellvorstellungen werden Kompetenzen neu erworben oder vorhandene weiterentwickelt.
Die Verknüpfung gewonnener Erkenntnisse mit bereits geläufigen Konzepten, Modellen und Theorien führt zur Fähigkeit, chemische Phänomene zu erkennen und zu erklären. - Kommunikation: Für einen fachbezogenen reflektierenden Informationsaustausch gilt es eine Kommunikationskompetenz zu entwickeln, in der eine sachgemäße Verknüpfung von Alltags- und Fachsprache gelingt. Neben der verbalen Form des Kommunizierens lassen sich chemische Zusammenhänge je nach Kontext und Inhalt auch in anderen Formen wie der symbolischen und mathematischen Form darstellen.
- Bewertung: Durch eine gezielte Auswahl chemierelevanter Kontexte gelingt es den Schülerinnen und Schülern, die Vernetzungen der Chemie in Lebenswelt, Alltag, Umwelt und Wissenschaft zu erkennen, zu reflektieren, zu bewerten, sachgerecht ihre eigene Meinung zu vertreten und ihr Handeln anzupassen.
Zu beachten ist, dass die Vermittlung sowohl der inhaltsbezogenen wie auch der prozessbezogenen Kompetenzen gezielt in der Unterrichtsplanung und in den Lernzielkontrollen zu berücksichtigen ist. Damit wird es zu einem wichtigen Ziel des Chemieunterrichts, die Schülerinnen und Schüler zum selbstständigen Anwenden chemischer Denk- und Arbeitsweisen zu führen und explizit eine möglichst weitgehende Durchdringung von naturwissenschaftlichen Zusammenhängen zu ermöglichen.
Weitere Hinweise
Diese vier Kompetenzen werden in einem Chemieunterricht entwickelt, der seinen Beitrag dazu leistet,
- bei den Schülerinnen und Schülern Interesse zu wecken und sie zu motivieren, sich mit chemischen Fragestellungen auseinander zu setzen,
- lebensweltbezogene Aspekte einzubeziehen, z. B. durch die Auswahl von „Lerngegenständen“, die für die Schülerinnen und Schülern jetzt und im späteren Leben relevant sind (siehe Gemeinsamer Referenzrahmen für Naturwissenschaften (GeRRN), MNU Oktober 2017),
- durch Demonstrations- und Schülerexperimente in exemplarischer Weise den empirischen Charakter der Naturwissenschaft Chemie zu verdeutlichen,
- das Denken in Modellen und die Modellbildung zu schulen,
- eine korrekte Fachsprache zu nutzen und einzufordern,
- Basiskonzepte (Stoff-Teilchen, Struktur-Eigenschaften, chemische Reaktion, energetische Betrachtungen bei Stoffumwandlungen) zu vermitteln,
- Schülerinnen und Schüler zu einem sicheren, zeitgemäßen und nachhaltigen Umgang mit Ressourcen (Stoffen und Energie) zu erziehen (im Sinne einer Bildung für nachhaltige Entwicklung),
- naturwissenschaftliche Fragestellungen in fächerübergreifenden Kontexten zu betrachten und zu bewerten,
- einen Ausblick auf globale Zusammenhänge zu geben.
Durch die bewusste Entwicklung der genannten Kompetenzen und durch anschlussfähiges, berufsbezogenes Lernen werden die Schülerinnen und Schüler befähigt, die breitgefächerten Angebote des Bildungssystems nach ihren individuellen Interessen und Begabungen wahrzunehmen. Darüber hinaus eröffnet der Chemieunterricht zusammen mit den anderen Naturwissenschaften Perspektiven für den weiteren Bildungsweg und die spätere Berufs- und Studienwahl, insbesondere in chemisch-technischen und weiteren naturwissenschaftlichen Berufsfeldern.
Klasse 9
|
Vertiefung – Individualisiertes Lernen – Projektunterricht (VIP) |
20 |
||||||
|---|---|---|---|---|---|---|---|
|
|||||||
|
BPE 1 |
Sicherheitseinweisung und Laborgeräte |
4 |
|---|---|---|
|
Die Schülerinnen und Schüler verinnerlichen die auf den Arbeitsschutzrichtlinien basierenden vorgeschriebenen Verhaltensregeln in naturwissenschaftlichen Fachräumen und wenden alle Schutzmaßnahmen sicher an.
Dadurch erlangen sie Sicherheit für das praktische Arbeiten im Chemieunterricht sowie für den Umgang mit Gefahrstoffen im Alltag. |
||
|
BPE 1.1 |
Die Schülerinnen und Schüler wenden vorgegebene Regeln für die Durchführung von Experimenten an und begründen diese. Sie übertragen die Bedeutung von Gefahrstoffpiktogrammen und Gefährdungshinweisen auf die korrekte Handhabung von Stoffen und die zugehörigen Versuchsaufbauten. |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 2 |
Stoffe und ihre Eigenschaften |
14 |
|---|---|---|
|
Die Schülerinnen und Schüler erweitern die bisher im naturwissenschaftlichen Unterricht erworbenen Kenntnisse über Stoffe und ihre Eigenschaften. Sie erfahren, dass die Vielfalt von Stoffen auf unterschiedlichen Teilchen beruht. Bei der Beobachtung und Erklärung von Phänomenen wechseln sie zwischen Stoffebene und Teilchenebene.
|
||
|
BPE 2.1 |
Die Schülerinnen und Schüler untersuchen experimentell Stoffeigenschaften und beschreiben diese. Sie vergleichen Eigenschaftskombinationen bestimmter Stoffe bzw. Stoffgruppen. |
||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||
|
BPE 3 |
Chemische Reaktionen |
10 |
|---|---|---|
|
Die Schülerinnen und Schüler unterscheiden chemische Reaktionen von physikalischen Vorgängen. Sie erfahren, dass chemische Reaktionen mit stofflichen und energetischen Veränderungen einhergehen.
|
||
|
BPE 3.1 |
Die Schülerinnen und Schüler vergleichen die Stoffeigenschaften der Edukte und Produkte einer chemischen Reaktion. Sie beschreiben die damit verbundenen Stoffumwandlungen und den energetischen Verlauf. Die Schülerinnen und Schüler stellen dazu Wortgleichungen auf. |
||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||
|
BPE 3.2 |
Die Schülerinnen und Schüler beschreiben chemische Reaktionen als Veränderung und Umgruppierung von Teilchen. Sie wenden Elementsymbole zur Bezeichnung von Elementnamen an. |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
|
BPE 4 |
Atombau und Periodensystem |
12 |
|---|---|---|
|
Die Schülerinnen und Schüler verfeinern den Teilchenbegriff, indem sie die Entwicklung von Atommodellen anhand von historischen Experimenten nachvollziehen. Dabei machen sie sich vertraut mit der naturwissenschaftlichen Vorgehensweise: Fragestellung, Planung und Durchführung von Experimenten sowie Interpretation der Ergebnisse.
Sie erfahren, dass der Blick ins Atom nur mit physikalischen Methoden möglich ist und dass Modellvorstellungen die Veranschaulichung einer den menschlichen Sinnen nicht zugänglichen Dimension ermöglichen. Das Periodensystem der Elemente ergibt sich als Zusammenführung aus den chemischen Betrachtungen und den eingeführten Atommodellen und wird von den Schülerinnen und Schülern als Hilfsmittel genutzt. |
||
|
BPE 4.1 |
Die Schülerinnen und Schüler entwickeln mit dem Kern-Hülle-Modell ein differenziertes Atommodell. |
||||||
|---|---|---|---|---|---|---|---|
|
|||||||
|
BPE 4.2 |
Die Schülerinnen und Schüler skizzieren die Atomhülle mithilfe die Verteilung der Elektronen auf Schalen mit den entsprechenden Energieniveaus. |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 4.3 |
Die Schülerinnen und Schüler begründen den Zusammenhang zwischen Atombau, Reaktionsfähigkeit und Stellung der Elemente im PSE. Sie wenden die Informationen des Periodensystems zur Vorhersage der Eigenschaften von Elementen an. |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
|
BPE 5 |
Salze, Ionenbildung und Ionenbindung |
10 |
|---|---|---|
|
Die Schülerinnen und Schüler erfahren, dass chemische Reaktionen von Veränderungen in der Elektronenhülle begleitet sind. Sie leiten die stabile Elektronenkonfiguration ab und erkennen, dass Reaktionen vieler Hauptgruppenelemente einfachen Gesetzmäßigkeiten folgen. Für Beispiele der Salzbildung stellen sie stöchiometrisch korrekte Reaktionsgleichungen in Symbolschreibweise auf.
|
||
|
BPE 5.1 |
Anhand von Versuchen mit ausgewählten Salzen ermitteln die Schülerinnen und Schüler die charakteristischen Eigenschaften. |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 5.2 |
Die Schülerinnen und Schüler erläutern die Ionenbildung mithilfe geeigneter Eigenschaften von Salzen und unter Berücksichtigung der Elektronenkonfiguration von Metall- und Nichtmetallatomen. Darüber hinaus begründen sie die Bedeutung einer stabilen Elektronenkonfiguration für die Bildung von Ionen. |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 5.3 |
Die Schülerinnen und Schüler deuten die beobachtbaren Stoffeigenschaften auf der Teilchenebene. Mithilfe des Ionengittermodells von Natriumchlorid beschreiben sie die Raumstruktur eines Salzes. Sie stellen Reaktionsgleichungen von Salzbildungsreaktionen auf. |
||||||
|---|---|---|---|---|---|---|---|
|
|||||||
|
BPE 5.4 |
Die Schülerinnen und Schüler begründen die Bedeutung von Natriumchlorid für den Menschen als physiologisch und technisch wichtigen Mineralstoff. Sie erläutern die wirtschaftlichen Dimensionen des Abbaus von Salzvorkommen. |
||||||
|---|---|---|---|---|---|---|---|
|
|||||||
Zeit für Leistungsfeststellung
10
70
80
Klasse 10
|
Vertiefung – Individualisiertes Lernen – Projektunterricht (VIP) |
20 |
||||||
|---|---|---|---|---|---|---|---|
|
|||||||
|
BPE 6 |
Moleküle und Elektronenpaarbindung |
10 |
|---|---|---|
|
Die Schülerinnen und Schüler erklären das Zustandekommen chemischer Bindungen und erläutern den Zusammenhang zwischen Bindungsart und Eigenschaften von molekularen Stoffen.
|
||
|
BPE 6.1 |
Die Schülerinnen und Schüler erklären, dass Atome durch die Bildung einer Elektronenpaarbindung Edelgaskonfiguration erreichen. |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||
|
BPE 6.2 |
Die Schülerinnen und Schüler beschreiben mithilfe der zwischenmolekularen Wechselwirkungen wichtige Eigenschaften von Wasser. |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 7 |
Metalle und Metallbindung |
2 |
|---|---|---|
|
Die Schülerinnen und Schüler beschreiben Metalle als Stoffklasse, kennen deren wichtigste Eigenschaften und erklären diese mithilfe der Metallbindung.
|
||
|
BPE 7.1 |
Die Schülerinnen und Schüler beschreiben mithilfe des Elektronengasmodells die Bindung zwischen den Metallatomen in Metallen sowie chemische und physikalische Eigenschaften von Metallen. |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
|
BPE 8 |
Vergleich der verschiedenen Bindungsarten |
2 |
|---|---|---|
|
Die Schülerinnen und Schüler wenden Struktur-Eigenschafts-Beziehungen auf verschiedene Stoffklassen und ihre charakteristischen Bindungsarten an.
|
||
|
BPE 8.1 |
Die Schülerinnen und Schüler vergleichen und erklären die Besonderheiten der drei Bindungstypen und begründen charakteristische Stoffeigenschaften. |
||
|---|---|---|---|
|
|||
|
BPE 9 |
Chemisches Rechnen |
10 |
|---|---|---|
|
Die Schülerinnen und Schüler erlangen Verständnis für die quantitative Charakterisierung von Stoffportionen sowie Grundkenntnisse quantitativer stofflicher Zusammenhänge bei chemischen Reaktionen und deren Berechnungen. Sie verwenden die Stoffmenge als zentrale Größe in der Chemie.
|
||
|
BPE 9.1 |
Die Schülerinnen und Schüler erklären den Mol-Begriff, um damit |
||||
|---|---|---|---|---|---|
|
|||||
|
BPE 9.2 |
Die Schülerinnen und Schüler wenden Stoffmengenverhältnisse an, um damit quantitativ Stoffumsätze für Reaktionen in Alltag und Technik zu berechnen. |
||
|---|---|---|---|
|
|||
|
BPE 10 |
Säuren, Laugen, Neutralisation |
10 |
|---|---|---|
|
Die Schülerinnen und Schüler erweitern ihre Kenntnisse über Stoffe und Teilchen. Sie kennen die charakteristischen Ionen saurer und alkalischer Lösungen. Die typischen Eigenschaften der Lösungen werden aus Versuchen abgeleitet.
|
||
|
BPE 10.1 |
Die Schülerinnen und Schüler bestimmen saure und alkalische Lösungen des täglichen Lebens aufgrund ihrer Eigenschaften unter Verwendung standardisierter und natürlicher Indikatoren. |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
|
BPE 10.2 |
Die Schülerinnen und Schüler erklären die Zuordnung der entsprechenden Teilchen (Oxoniumionen und Hydroxidionen) zu sauren und alkalischen Lösungen. Sie stellen Reaktionsgleichungen zur Neutralisation auf. |
||||||||
|---|---|---|---|---|---|---|---|---|---|
|
|||||||||
|
BPE 11 |
Stoffklassen der organischen Chemie |
16 |
|---|---|---|
|
Die Schülerinnen und Schüler erweitern ihre Stoffkenntnisse mit Stoffklassen der organischen Chemie. Auf der Teilchenebene lernen sie den systematischen Aufbau und die daraus resultierende systematische Benennung kennen sowie die für die Stoffklassen typischen funktionellen Gruppen. Makroskopisch bekommen sie einen Überblick über die Verwendung und das Vorkommen der Stoffklassen im Alltag. Den Schülerinnen und Schülern gelingt es, typische Stoffeigenschaften und deren Veränderungen innerhalb einer Stoffklasse anhand der zugehörigen Strukturformel nachzuvollziehen und anhand von zwischenmolekularen Wechselwirkungen zu erklären.
|
||
|
BPE 11.1 |
Die Schülerinnen und Schüler nennen Vorkommen und Verwendung organischer Stoffe im Alltag. Sie bestimmen organische Moleküle der homologen Reihe der n-Alkane, ausgewählter Alkene, Alkanole und Alkansäuren auf Grund ihrer Struktur und ihrer funktionellen Gruppe. |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||
Zeit für Leistungsfeststellung
10
70
80
Operatorenliste
Anforderungsbereiche
Anforderungsbereiche
Anforderungsbereich I umfasst die Wiedergabe von Sachverhalten aus einem abgegrenzten Gebiet im gelernten Zusammenhang sowie die Beschreibung und Verwendung gelernter und geübter Arbeitstechniken und Verfahrensweisen in einem begrenzten Gebiet und in einem wiederholenden Zusammenhang.
Anforderungsbereich II umfasst selbstständiges Auswählen, Anordnen und Darstellen bekannter Sachverhalte untervorgegebenen Gesichtspunkten in einem durch Übung bekannten Zusammenhang sowie selbstständiges Übertragen des Gelernten auf vergleichbare neue Situationen, wobei es entweder um veränderte Fragestellungen oder um veränderte Sachzusammenhänge oder um abgewandelte Verfahrensweisen geht.
Anforderungsbereich III umfasst planmäßiges und kreatives Bearbeiten komplexerer Problemstellungen mit dem Ziel, selbstständig zu Lösungen, Deutungen, Wertungen und Folgerungen zu gelangen sowie bewusstes und selbstständiges Auswählen und Anpassen geeigneter gelernter Methoden und Verfahren in neuartigen Situationen.
| Operator | Erläuterung |
Zuordnung AFB |
|---|---|---|
| analysieren, untersuchen |
unter einer gegebenen Fragestellung wichtige Bestandteile oder Eigenschaften herausarbeiten; Untersuchen beinhaltet unter Umständen zusätzlich praktische Anteile
|
II |
| anwenden, übertragen |
einen bekannten Sachverhalt oder eine bekannte Methode auf etwas Neues beziehen
|
II, III |
| auswerten |
Daten, Einzelergebnisse oder sonstige Sachverhalte in einen Zusammenhang stellen oder gegebenenfalls zu einer abschließenden Gesamtaussage zusammenführen
|
II, III |
| begründen |
Sachverhalte auf Regeln, Gesetzmäßigkeiten bzw. kausale Zusammenhänge zurückführen
|
II |
| berechnen, bestimmen |
mittels Größengleichungen eine chemische oder physikalische Größe bestimmen
|
I, II |
| beschreiben |
Strukturen, Sachverhalte oder Zusammenhänge wiedergeben
|
I, II |
| bestätigen |
die Gültigkeit einer Aussage, z. B. einer Hypothese oder einer Modellvorstellung, durch ein Experiment verifizieren
|
II, III |
| beurteilen |
zu einem Sachverhalt eine selbstständige Einschätzung unter Verwendung von Fachwissen und Fachmethoden begründet formulieren
|
II, III |
|
bewerten, Stellung nehmen |
eine eigene Position nach ausgewiesenen Kriterien vertreten
|
III |
| darstellen |
Sachverhalte, Zusammenhänge, Methoden und Bezüge in angemessenen Kommunikationsformen strukturiert wiedergeben
|
I, II |
| diskutieren |
in Zusammenhang mit Sachverhalten, Aussagen oder Thesen unterschiedliche Positionen bzw. Pro- und Contra-Argumente einander gegenüberstellen und abwägen
|
II, III |
| dokumentieren |
alle notwendigen Erklärungen, Herleitungen und Skizzen darstellen
|
I, II |
| durchführen (Experimente) |
eine vorgegebene oder eigene Experimentieranleitung umsetzen
|
I, II |
| entwickeln, aufstellen |
Sachverhalte und Methoden zielgerichtet miteinander verknüpfen; eine Hypothese, eine Skizze, ein Experiment oder ein Modell schrittweise weiterführen und ausbauen
|
II, III |
| erklären |
einen Sachverhalt nachvollziehbar und verständlich zum Ausdruck bringen
|
I, II |
| erläutern |
einen Sachverhalt durch zusätzliche Informationen (chemische Formeln und Gleichungen) veranschaulichen und verständlich machen
|
II |
| ermitteln |
einen Zusammenhang oder eine Lösung finden und das Ergebnis formulieren
|
II |
| interpretieren, deuten |
kausale Zusammenhänge in Hinblick auf Erklärungsmöglichkeiten untersuchen und abwägend herausstellen
|
II, III |
| nennen, angeben |
Elemente, Sachverhalte, Begriffe, Daten ohne nähere Erläuterungen aufzählen
|
I |
| planen (Experimente) |
zu einem vorgegebenen Problem eine Experimentieranleitung erstellen
|
II |
| skizzieren |
Sachverhalte, Strukturen oder Ergebnisse auf das Wesentliche reduzieren und diese grafisch oder als Fließtext übersichtlich darstellen
|
II |
| strukturieren, ordnen |
vorliegende Objekte oder Sachverhalte kategorisieren und hierarchisieren
|
II |
| überprüfen, prüfen |
Sachverhalte oder Aussagen an Fakten oder innerer Logik messen und eventuelle Widersprüche aufdecken
|
II |
| verallgemeinern |
aus einem erkannten Sachverhalt eine erweiterte Aussage formulieren
|
II |
| vergleichen |
Gemeinsamkeiten, Ähnlichkeiten und Unterschiede ermitteln
|
II |
| zeichnen |
eine anschauliche und hinreichend exakte grafische Darstellung beobachtbarer oder gegebener Strukturen anfertigen
|
I, II |
Amtsblatt des Ministeriums für Kultus, Jugend und Sport Baden-Württemberg
Lehrplanheft 3/2020
hier:
Berufliches Gymnasium der sechsjährigen Aufbauform
Vom 23. Juli 2020
44 – 6512.- 240/211
I.
II.
Im Zeitpunkt des Inkrafttretens tritt der im Lehrplanheft 7/2004 veröffentlichte Lehrplan in diesem Fach vom 25. November 2004 (Az. 45-6512-240/92) außer Kraft.
